您现在的位置是: 首页 > 教育新闻 教育新闻
高考最难化学压轴题_最难高考化学题
tamoadmin 2024-05-23 人已围观
简介1.几个高三的化学问题2.化学有机推断题3.2021河北新高考化学难不难?选择题答案是什么?4.2023广东高考化学难度5.高考化学压轴题有多难2023年福建省高考化学试题总体来说是比较难的。虽然考的试题内容非常基础,但是题目创新性非常高,这给很多考生带来了不小的压力。福建高考化学试卷总体来说有难度,高考化学科试卷,坚持“以稳为主、稳中有变、稳中求新。2023年福建高考化学试题难度如何2023年福
1.几个高三的化学问题
2.化学有机推断题
3.2021河北新高考化学难不难?选择题答案是什么?
4.2023广东高考化学难度
5.高考化学压轴题有多难
2023年福建省高考化学试题总体来说是比较难的。
虽然考的试题内容非常基础,但是题目创新性非常高,这给很多考生带来了不小的压力。福建高考化学试卷总体来说有难度,高考化学科试卷,坚持“以稳为主、稳中有变、稳中求新。
2023年福建高考化学试题难度如何
2023年福建省高考化学试题总体来说是比较难的。化学试题难不难想必一定是考生讨论的热门话题,有的人觉得难,有的人觉得不难。
福建高考化学还是比较难的,虽然考的试题内容非常基础,但是题目创新性非常高,这给很多考生带来了不小的压力。
今年高考命题将保持试卷结构、题型题量以及考试难度的相对稳定。今年高考是疫情防控常态化下的高考,同时也是高考改革深入推进形势下的一次高考,今年的高考命题重点从铸魂育人、落实改革、确保稳定三个方面开展。
2023福建高考化学试卷的难度解析
福建高考化学试卷总体来说有难度,高考化学科试卷,坚持“以稳为主、稳中有变、稳中求新、平稳推动”的根本原则,力求反映高中新课程理念,力求使试题命制在科学性与标准性、难度与区分度、公正性与合理性等方面相统一。
2023福建高考化学试卷难度单单从试卷的试题本身来说,这个和每个人的知识点掌握程度和擅长的题目类型有关系,还和个人的临场发挥有关联,高考考生现场状态非常重要。
拓展知识:
对于化学知识的联系和拓展也非常重要,需要学生灵活掌握系统化的解题思路,培养自己逻辑思维的能力,吸收更多的实际经验和知识,不断将学到的知识融汇贯通,并且能够理清技巧和方法与理论之间的关系。
考虑到化学等级考对高校招生入学的影响,2023年的化学等级考难度相对会更高。因此,同学们在备考时一定要认真复习所学知识,注重提高综合应用能力,保持练习和思考的频率,同时要注意掌握好考试过程中的答题技巧和方法。
几个高三的化学问题
勤奋学习应体现在我们生活和学习中的每一个环节,按时起床,充分预习,认真听讲,积极思考,踊跃发言,及时复习,独立作业,敢于质疑,善于合作,勇于创新;重视每一门学科,关注社会和时代的发展,并且坚持不懈,以下是我给大家整理的 高三化学 最难知识点,希望能帮助到你!
高三化学最难知识点1
“元素化合物”知识模块
1.碱金属元素原子半径越大,熔点越高,单质的活泼性越大错误,熔点随着原子半径增大而递减
2.硫与白磷皆易溶于二硫化碳、四氯化碳等有机溶剂,有机酸则较难溶于水
3.在硫酸铜饱和溶液中加入足量浓硫酸产生蓝色固体正确,浓硫酸吸水后有胆矾析出
4.能与冷水反应放出气体单质的只有是活泼的金属单质或活泼的非金属单质错误,比如2Na2O2+2H2O→O2↑+4NaOH
5.将空气液化,然后逐渐升温,先制得氧气,余下氮气
错误,N2的沸点低于O2,会先得到N2,留下液氧
6.把生铁冶炼成碳素钢要解决的主要问题是除去生铁中除Fe以外各种元素,把生铁提纯错误,是降低生铁中C的百分比而不是提纯
7.虽然自然界含钾的物质均易溶于水,但土壤中K%不高,故需施钾肥满足植物生长需要错误,自然界钾元素含量不低,但以复杂硅酸盐形式存在难溶于水
8.制取漂白粉、配制波尔多液以及改良酸性土壤时,都要用到熟石灰正确,制取漂白粉为熟石灰和Cl2反应,波尔多液为熟石灰和硫酸铜的混合物
9.二氧化硅是酸性氧化物,它不溶于酸溶液错误,SiO2能溶于氢氟酸
10.铁屑溶于过量盐酸,再加入氯水或溴水或碘水或硝酸锌,皆会产生Fe3+错误,加入碘水会得到FeI2,因为Fe3+的氧化性虽然不如Cl2,Br2,但是强于I2,在溶液中FeI3是不存在的
11.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应错误,钝化是化学性质,实质上是生成了致密的Al2O3氧化膜保护着铝罐
12.NaAlO2、Na2SiO3、Na2CO3、Ca(ClO)2、NaOH、C17H35COONa、C6H5ONa等饱和液中通入CO2出现白色沉淀,继续通入CO2至过量,白色沉淀仍不消失错误,Ca(ClO)2中继续通CO2至过量,白色沉淀消失,最后得到的是Ca(HCO3)2
13.大气中大量二氧化硫来源于煤和石油的燃烧以及金属矿石的冶炼正确
14.某澄清溶液由NH4Cl、AgNO3、NaOH三种物质混合而成,若加入足量硝酸必产生白色沉淀
正确,NH4Cl、AgNO3、NaOH混合后发生反应生成[Ag(NH3)2]+加入足量硝酸后生成AgCl和NH4NO3
15.为了充分利用原料,硫酸工业中的尾气必须经净化、回收处理错误,是为了防止大气污染
16.用1molAl与足量NaOH溶液反应,共有3mol电子发生转移正确
17.硫化钠既不能与烧碱溶液反应,也不能与氢硫酸反应错误,硫化钠可以和氢硫酸反应:Na2S+H2S=2NaHS
18.在含有较高浓度的Fe3+的溶液中,SCN-、I-、AlO-、S2-、CO32-、HCO3-等不能大量共存
正确,Fe3+可以于SCN-配合,与I-和S2-发生氧化还原反应,与CO32-,HCO3-和AlO2-发生双水解反应
19.活性炭、二氧化硫、氯水等都能使品红褪色,但反应本质有所不同正确,活性炭是吸附品红,为物理变化,SO2是生成不稳定的化合物且可逆,氯水是发生氧化还原反应且不可逆
20.乙酸乙酯、三溴苯酚、乙酸钠、液溴、玻璃、重晶石、重钙等都能与烧碱反应错误,重晶石(主要成分BaSO4)不与烧碱反应
21.在FeBr2溶液中通入一定量Cl2可得FeBr3、FeCl2、Br2错误,Fe2+和Br2不共存
22.由于Fe3+和S2-可以发生氧化还原反应,所以Fe2S3不存在错误,在PH=4左右的Fe3+溶液中加入Na2S可得到Fe2S3,溶度积极小
23.在次氯酸钠溶液中通入少量二氧化硫可得亚硫酸钠与次氯酸错误,次氯酸可以氧化亚硫酸钠,会得到NaCl和H2SO4
24.有5.6g铁与足量酸反应转移电子数目为0.2NA错误,如果和硝酸等强氧化性酸反应转移0.3NA
25.含有较高价元素的化合物不一定具有强氧化性
正确,如较稀的HClO4,H2SO4等
26.单质的还原性越弱,则其阳离子的氧化性越强错误,比如Cu的还原性弱于铁的,而Cu2+的氧化性同样弱于Fe3+
27.CuCO3可由Cu2+溶液中加入CO32-制得错误,无法制的纯净的CuCO3,Cu2+溶液中加入CO32-会马上有Cu2(OH)2CO3生成
28.单质X能从盐的溶液中置换出单质Y,则单质X与Y的物质属性可以是:(1)金属和金属;(2)非金属和非金属;(3)金属和非金属;(4)非金属和金属;
错误,(4)非金属和金属不可能发生这个反应
29.H2S、HI、FeCl2、浓H2SO4、Na2SO3、苯酚等溶液在空气中久置因发生氧化还原反应而变质
错误,H2SO4是因为吸水且放出SO3而变质
30.浓硝酸、浓硫酸在常温下都能与铜、铁等发生反应错误,浓硫酸常温与铜不反应
高三化学最难知识点2
1、守恒规律
守恒是氧化还原反应最重要的规律。在氧化还原反应中,元素的化合价有升必有降,电子有得必有失。从整个氧化还原反应看,化合价升高总数与降低总数相等,失电子总数与得电子总数相等。此外,反应前后的原子个数、物质质量也都守恒。守恒规律应用非常广泛,通常用于氧化还原反应中的计算问题以及方程式的配平问题。
2、价态规律
元素处于价,只有氧化性,如浓硫酸中的硫是+6价,只有氧化性,没有还原性;元素处于,只有还原性,如硫化钠的硫是-2价,只有还原性,没有氧化性;元素处于中间价态,既有氧化性又有还原性,但主要呈现一种性质,如二氧化硫的硫是+4价,介于-2与+6之间,氧化性和还原性同时存在,但还原性占主要地位。物质大多含有多种元素,其性质体现出各种元素的综合,如H2S,既有氧化性(由+1价氢元素表现出的性质),又有还原性(由-2价硫元素表现出的性质)。
3、难易规律
还原性强的物质越易失去电子,但失去电子后就越难得到电子;氧化性强的物质越易得到电子,但得到电子后就越难失去电子。这一规律可以判断离子的氧化性与还原性。例如Na还原性很强,容易失去电子成为Na+,Na+氧化性则很弱,很难得到电子。
4、强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。用这一性质可以判断物质氧化性或还原性的强弱。如2HI+Br2=2HBr+I2,氧化物Br2的氧化性大于氧化产物I2的.氧化性。还原剂HI的还原性大于还原产物HBr的还原性。
5、歧化规律
同一种物质分子内同一种元素同一价态的原子(或离子)发生电子转移的氧化还原反应叫歧化反应,歧化反应的特点:某元素的中间价态在适宜条件下同时向较高和较低的价态转化。歧化反应是自身氧化还原反应的一种。如Cl2+H2O=HCl+HClO,氯气中氯元素化合价为0,歧化为-1价和+1价的氯。
6、归中规律
(1)同种元素间不同价态的氧化还原反应发生的时候,其产物的价态既不相互交换,也不交错。
(2)同种元素相邻价态间不发生氧化还原反应;当存在中间价态时,同种元素的高价态物质和低价态物质才有可能发生反应,若无中间价态则不能反应。如浓硫酸和SO2不能反应。
(3)同种元素的高价态氧化低价态的时候,遵循的规律可简单概括为:高到高,低到低,可以归中,不能跨越。
高三化学最难知识点3
1.碱性物质:
①碱性:NaOH、NH3·H2O、NaHCO3、Na2CO3、NaAlO2、Na2SiO3等
②碱性+氧化性:Na2O2、NaClO、NaNO2、Fe(OH)3等
③碱性+还原性:Na2SO3、Na2S、Fe(OH)2等
2.酸性物质:
①酸性:HCl(稀)、H2SO4(稀)、H2CO3、NaHSO4、AlCl3、NH4Cl等
②酸性+氧化性:HNO3、H2SO4(浓)、HClO、FeCl3、CuSO4等
③酸性+还原性:H2S、H2SO3、HI、FeSO4等
3.中性物质:
①中性:Na2SO4、CaCl2、Ba(NO3)2等
②中性+还原性:NaI、KBr等
如果反应物都是碱性物质,它们若不发生复分解反应,仅是发生氧化还原反应,我们只需要依据氧化还原反应的规律就可以完成方程式的书写。
例如:Na2O2+Na2S+2H2O=4NaOH+S↓
同理,如果反应物都是酸性物质,若不发生复分解反应,仅发生氧化还原反应。只需要依据氧化还原反应的规律就可以完成方程式的书写。
例如:2FeCl3+2HI=2FeCl2+2HCl+I2
当然,如果是酸、碱性物质与中性物质反应时,可能有以下两种情况:
(1)发生生成沉淀的复分解反应;
例如:CaCl2+Na2CO3=2NaCl+BaCO3↓
H2SO4+Ba(NO3)2=BaSO4↓+2HNO3
(2)发生氧化还原反应。
例如:2NaI+Na2O2+2H2O=4NaOH+I2
2NaI+2FeCl3=2FeCl2+2NaCl+I2
在高中涉及的反应中,难度较大的是以下两类反应:
①既有酸性又有氧化性的物质与既有碱性又有还原性的物质之间的反应;
②既有酸性又有还原性的物质与既有碱性又有氧化性的物质之间的反应。
这两类反应我们既要考虑复分解反应又要考虑氧化还原反应。书写时应该考虑氧化还原反应优先原则,再考虑复分解反应。
例如:
⑴2FeCl3+Na2S=2FeCl2+2NaCl+S↓
⑵H2S+NaClO=NaCl+S↓+H2O
⑶10HNO3+3Fe(OH)2=3Fe(NO3)3+NO↑+8H2O
⑷6HI+2Fe(OH)3=2FeI2+I2+6H2O
高三化学最难知识点相关 文章 :
★ 高三化学必备知识点总结
★ 高三化学复习知识点归纳
★ 高三化学必背知识点小归纳
★ 高三化学知识点小结
★ 化学高三复习所有基础知识点汇总
★ 2020年高考化学最全重点知识点归纳
★ 高三化学必备知识点的归纳
★ 高三化学必背知识点
★ 高三化学复习必背知识点总结归纳
★ 高三化学必背知识点归纳
化学有机推断题
1、吸水性、溶于水放出大量热、难挥发性均有体现
2、负极反应:CH4+4CO3 2- -8e- =5CO2+2H2O (二氧化碳在负极生成)
正极反应:2O2+CO2 +8e-=4CO3 2- (正极需要通入二氧化碳)
此电池是用熔融的碳酸钾作电解质,电解质中没有水,可以传递氧原子的只能是碳酸根离子,所以负极区要消耗碳酸根,正极区必然要收成碳酸根,所以正极区(通入空气或氧气一极)必须消耗二氧化碳
3、亚硝酸根在酸性条件下很不稳定,具有比同浓度硝酸根有更强的氧化性,所以不会生成亚硝酸根。正是亚硝酸很不稳定,所以我们基本上见不到亚硝酸。
2021河北新高考化学难不难?选择题答案是什么?
高考化学总复习有机推断与有机合成题型应考策略
思 考 方 法
一、有机物的推断
1.有机物的推断一般有以下几种类型:(1)由结构推断有机物 (2)由性质推断有机物(3)由实验推断有机物 (4)由计算推断有机物等
2.有机物的推断方法分为顺推法、逆推法和猜测论证法
(1)顺推法。以题所给信息顺序或层次为突破口,沿正向思路层层分析推理,逐步作出推断,得出结论。
(2)逆推法。以最终物质为起点,向前步步递推,得出结论,这是有机合成推断题中常用的方法。
(3)猜测论证法。根据已知条件提出假设,然后归纳、猜测、选择,得出合理的假设范围,最后得出结论。其解题思路为:
审题 印象 猜测 验证
(具有模糊性) (具有意向性) (具有确认性)
二、有机合成常见题型通常有:自行设计合成路线和框图(指定合成路线)两种
1.解题思路简要如下:
2.有机合成常用的解题方法:
解答有机合成的常用方法有“正推法”和“逆推法”。具体某个题目是用正推法还是逆推法,或是正推、逆推双向结合,这由题目给出条件决定。近几年考题中出现的问题多以逆推为主,使用该方法的思维途径是:
(1)首先确定所要合成的有机物属于何类别,以及题中所给定的条件与所要合成的有机物之间的关系。
(2)以题中要求最终产物为起点,考虑这一有机物如何从另一有机物甲经过一步反应而制得,若甲不是所给已知原料,需再进一步考虑甲又是如何从另一有机物乙经过一步反应制得,一直推导到题目中给定的原料为终点。
(3)在合成某一种产物时,可能会产生多种不同的方法和途径,应在兼顾原料省、副产物少、产率高、环保好的前提下选择最合理、最简单的方法和途径。
热 点 荟 萃
一、有机推断、有机合成的常用方法
1.官能团的引入
(1)引入双键 ①通过消去反应得到C=C双键,如醇、卤代烃的消去反应
②通过氧化反应得到- -,如烯烃、醇的氧化
(2)引入-OH
①加成反应:烯烃与水的加成、醛酮与H2的加成 ②水解反应:卤代烃水解、酯的水解、醇钠(盐)的水解
(3)引入-COOH
①氧化反应:醛的氧化 ②水解反应:酯、蛋白质、羧酸盐的水解
(4)引入-X
①加成反应:不饱和烃与HX加成 ②取代反应:烃与X2、醇与HX的取代
2.官能团的改变 (1)官能团之间的衍变如:伯醇 醛 羧酸 酯
(2)官能团数目的改变
如:①
②
(3)官能团位置的改变
如:①
②
3.官能团的消除
(1)通过加成可以消除C=C或C≡C (2)通过消去、氧化、酯化可以消除-OH
(3)通过加成(还原)或氧化可以消除- -H (4)通过水解反应消除- -O-(酯基)
4.碳骨架的增减
(1)增长:有机合成题中碳键的增长,一般会以信息形式给出,常见方式有酯化、有机物与HCN反应以及不饱和化合物间的加成、聚合等。
(2)变短;如烃的裂化裂解、某些烃(如苯的同系物、烯烃)的氧化、羧酸盐脱羧反应等。
二、常见有机反应条件与反应类型
反应条件 有机反应
X2、光照 烷烃或芳香烃的烷基上的卤代
溴、铁粉(FeBr3) 苯环上的卤代
浓硝酸、浓硫酸 苯环上的硝化
浓溴水 苯酚的溴代
氢氧化钠水溶液、加热 酯水解和卤代烃取代反应
氢氧化钠的乙醇溶液加热 卤代烃消去反应
稀硫酸、加热 酯的可逆水解或二糖、多糖水解
浓硫酸、加热 酯化反应,醇消去成烯,脱水成醚
KMnO4(H+) 不饱和有机物的氧化反应
溴水 不饱和有机物的加成反应
Cu(O2)加热 醇的催化氧化
水浴加热 苯的硝化、银镜反应、*制酚醛树脂、
酯类和二糖的水解
三、反应条件不同、产物不同的几种情况
四、三个重要相对分子质量增减的规律
1.RCH2OH RCHO RCOOH
M M-2 M+14
2.RCH2OH CH3COOCH2R
M M+42
3.RCOOH RCOOCH2CH3
M M+28
五、由高分子有机物结构确定单体
首先确定高分子化合物是加聚产物还是缩聚产物,若链节结构中.主链上是碳与碳原子形成碳键,则一般为加聚产物;若链节结构中主链上有- -O-或- -NH-,则一般为缩聚产物。若为加聚产物,将加聚物的链节取出,单键改双键,双键改单,再断开错误的双键(以C为4价键判),得出加聚物单体;若为缩聚产物,只要将主链中的 或 断开,分别补上(左)-OH和(右)-H即可得出相反应单体。
六、有机成环反应方法
1.有机成环反应规律有机成环方式一种是通过加成反应、聚合应来实现的,另一种是至少含有两个相同或不同官能团的有机物分子,如多元醇、羟基酸、氨基酸通过分子内或分子间脱去小分子(如水或氨等)而成环。
2.有机成环反应类型
(1)聚合反应:如乙炔的聚合
3CH≡CH
甲醛、乙醛等容易聚合而成环状化合物。
(2)脱水反应
多元醇脱水:①分子内脱水。如: +H2O
②分子间脱水,如
+2H2O
(3)酯化反应:多元醇与多元酸酯化反应生成环状酯,如
+2H2O
羟基酸酯化反应:分子内酯化,如
分子间酯化,如
(4)缩合反应。氨基酸可以分子内缩合合成内酰胺,也可分子间缩合成环状酰胺。分子内缩合:如
分子间缩合:如
应 对 策 略
一、利用结构性质推断
有机物性质是与其所具有的官能团相对应的,可根据有机物的某些性质(如反应对象、反应条件、反应数据、反应特征、反应现象、反应前后分子式的差异等等)。首先确定其中的官能团及位置,然后再结合分子式价键规律、取代产物的种类、不饱和度等确定有机物的结构简式,再根据题设要求进行解答。
例1 有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色,且难溶于水,但在酸性条件可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有____________________(选填序号)
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
(2)B分子所含官能团的名称是____________________、____________________。
(3)B分子中没有支链,其结构简式是____________________,B的具有相同官能团的同分异构体的结构简式是____________________。
(4)由B制取A的化学方程式是____________________。
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取天门冬氨酸。天门冬氨酸的结构简式是____________________。
解析:(1)由于A能使溴水褪色,说明分子中含碳碳双键,故能发生加成、加聚及氧化反应。
(2)A在酸性条件下水解得B和醇,说明A含酯基,故B中应含羧基、碳碳双键。
(3)从不饱和度看B少6个氢原子,含一个碳碳双键(少2H),又含羧基,还需少4H,则应是含两个羧基,故可推出B的结构。
(5)由B到C应是加成,C中应含氯原子,由C到天门冬氨酸必然是-NH2取代了氯原子。
答案: (1)①③④ (2)碳碳双键、羧基
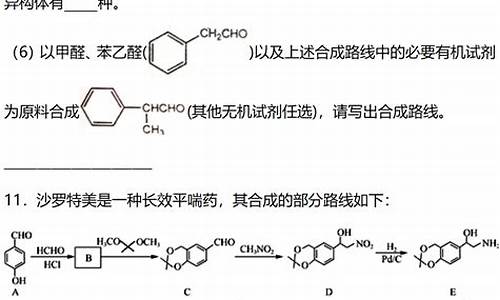
例2 化合物A(C8H8O3)为无色液体、难溶于水、有特殊香味的物质,从A出发可发生如图所示的一系列反应,化合物A硝化时可生成4种-硝基取代物,化合物H分子式为C6H6O,
G能发生银镜反应。(已知RCOONa+NaOH RH+Na2CO3)
请回答:(1)下列化合物可能的简式:A____________________,E____________________。
(2)反应类型:(I)____________________,(II)____________________,(III)____________________。
(3)写出下列反应的化学方程式:
①H→K:__________________________________;
②C→E:__________________________________;
③C+F→G:__________________________________。
解析:根据反应条件I和A有特殊香味,可推知A为酯,由B→D条件说明B有-COONa,由H→K加溴水有白色沉淀可知H为 ,则A、B中均应含有“ ”结构。根据A→B→D→H的碳原子数变化可推知C为含一个碳原子的甲醇。则A中还应有“ ”结构。A有4种一硝基化合物可确定A中-OH和- -OCH3邻位。
答案:
(1) 或 ;H- -H
(2)消解反应;取代(酯化)反应;取代反应
(3) +3Br2 ↓+3HBr;
2CH3OH+O2 2HCHO+2H2O; CH3OH+HCOOH HCOOCH3+H2O
二、利用数据、实验推断数据往往起突破口的作用,常用来确定某种有机物分子式或官能团的数目或推测发生的反应类型。
利用实验推断实际是利用实验现象、实验条件、实验对象、实验中相关物质的个数比、同分异构体的个数等等来推测有机物的结构简式。对相关实验知识必须要熟悉。需要注意的是这尖题经常同时考查“实验现象描述”或“实验结论的判断”等方面的书写。
例3 下列图示表示A、B、C、D之间的相互转化关系,其中A能跟NaOH溶液反应,B能使溴水褪色。
请回答下列问题:
(1)写出A可能的各种结构简式:____________________。
(2)反应①和②的反应类型分别为:反应①____________________;反应②____________________。 (3)若将A催化氧化可得另一种化合物E,E可发生银镜反应,则E的结构简式为____________________。写出A转化为B的化学方程式:____________________。
解析:从A→D的反应条件及对象可知,A含有-COOH,从134→162。结合酯化反应前后相对分子质量的变化特征(每结合一个甲酯相对分子质量增加14),可推知A有两个-COOH;而C4H6O5相对于C4H10减少4个氢原子,正好是两个-COOH所致,所以A中不含其他不饱和键。则再从A→B的反应条件及B使溴水褪色可推知,A中有一个-OH(所以A中只有5个O,两个-COOH只用去4个O)。
答案:
(2)消去反应;加成反应
例4 有机物A的相对分子质量不超过150,经测定,A具有下列性质:
A的性质 推断A的组成、结构
①A的燃烧产物只有CO2和H2O
②A与醇或羧酸在浓H2SO4共热条件下均能生成有香味的物质
③一定条件下,A可发生分子内的脱水反应,生成物与溴水混合,溴水褪色
④0.1molA与足量NaHCO3溶液反应放出标准状况下4.48L气体
(1)填写表中空白部分的内容。
(2)已知A中含氧元索的质量分数为59.7%,写出A所有可能的结构简式:____________________。
(3)若A分子内无含碳支链,写出反应③的化学方程式:____________________。
(4)A不可能发生的反应类型有(填序号)____________________。
a.水解反应 b.取代反应 c.加成反应 d.消去反应 e.加聚反应 f.缩聚反应
(5)下列物质与A互为同分异构体的是(填序号)__________,互为同系物的是(填序号)___________。
解析:从④的数据和②的表述可以椎知一个A含两个-COOH,至少有一个-OH,则A至少含3个氧原子,由A中ω(O)=59.7%且M(A)≤150。知A中氧原子数最多为 %=5.59,假设A有3个氧原子,则M(A)= %≈80,而两个-COOH式量即为90,不合题意。A有4个氧原子,M(A)≈107,而两个-COOH、一个-OH式量之和为107。不合题意。A有5个氧原子,M(A)=134,分子中C、H的相对分子质量之和为54。商余法求得“C4H6”,所以A的分子式为C4H6O5,羧基必须在端点。即可写出相应的结构简式。
答案:(1)①A中一定含C、H两种元素,可能含氧元素,不合其他元素
②A结构既有-COOH又有-OH
④A结构中含有两个-COOH
(4)a、c、e
(5)a、b、B+g
三、利用信息推断
解答此类题时,对试题给予的信息进行分析,区分哪些是有用的信息,哪些是与解题无关的信息,一定要围绕如何利用信息这个角度来思考,对于信息方程式要观察旧化学键的断裂(位置)方式和新化学键的生成(位置)方式,反应物和产物结构上的差异。找出新信息与题目要求及旧知识之间的联系,同时解题过程中要不断地进行验证或校正。
例5 设R为烃基,已知RX+Mg RMgX(格林试剂)
分析下列合成线路,回答有关问题。
(1)以上①~⑦步反应中属于加成反应的是____________________。
(2)写出A、D、E的结构简式:A__________________,D__________________,E__________________。
(3)分别写出第④和⑥步反应的化学方程式:④____________________,⑥____________________。
解析:信息迁移题。关键是思考如何用信息,格林试剂就是直接把 =O变成- -OH,再增加了烃基R,是一种延长碳链的方法,难点在于是否注意题目的暗示。D有6个C,B和C2H4O结合,则应观察出B为XMgCH2CH2MgX,套用信息,则C的结构简式为
答案:(1)①④⑦
四、有机合成
1.有机合成中官能团掩蔽和保护和定位定位合成,在有机合成中,尤其是含有多个官能团的有机物的合成中属于难点,多种官能团之间会相互影响和相互制约,即当制备某一官能团或拼接碳链时,分子中已有的官能团或者被破坏,或者首先发生反应,因而造成在制备的过程中要把分子中已存在的某种官能团先用恰当的方法掩蔽而保护起来,在适当的时候再把它转变过来,从而达到合成的目的。常见需保护的情况。如“氧化时先保护 ”,“对 加成时先保护-CHO”,“对苯环邻位(或对位)取代时先保护对位(或邻位)”,“氧化其他基团时先保护醛基”等等。
2.信息类有机合成仍以“围绕如何运用信息”这点来寻求突破点。
例6 6-羰基庚酸是合成某些高分子材料和药材的重要中间体,某实验室以溴代甲基环已烷为原料合成6-羰基庚酸。请用合成反应流程图表示出最合理的合成方案(注明反应条件)
提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
A B C…… H
解析: 这是一道有机合成题。本题中有几个重要信息①环状反应物是终生成链状生成物,判断断键位置,如何断键;②反应物为卤代烃的性质,发生一系列反应后断键;③生成物中有- -、-COOH,说明是发生了氧化以后的产物,本题采用逆推法 ,很明显此处依信息碳碳键断裂并加氧,再考虑如何在环上形成双键,依据卤代烃的性质进行一系列反应,此题就可顺利完成。
答案:
例7 在有机分析中,常用臭氧氧化水解来确定有机物中碳碳双键的位置与数目。如:
(CH3)2C=CH-CH3 (CH3)2C=O+CH3CHO
已知某有机物A经臭氧氧化水解后发生下列一系列的变化:
试回答下列问题:
(1)写出有机物A、F的结构简式:A____________________,F____________________。
(2)从B合成E通常要经过几步有机反应,其中最佳的次序应是____________________。
A.水解、酸化、氧化 B.氧化、水解、酸化
C.水解、酸化、还原 D.氧化、水解、酯化
(3)写出下列变化的化学方程式:①I水解生成E和H:____________________,②F制取G:____________________。
解析:观察I显然由两部分 (E)和CH3 COOH(H)反应而得,结合G的分子式逆推G为CH3 COOH,紧扣信息方程式键的断裂和生成方式,则F为CH3 CH2OH,结合观察信息方程式前后,知B的分子式为C7H5OBr,因B中一定有“- -”,对照E的结构(B→E碳链不变)知B为 ,套用信息则A为 ,从B→E,若先把“-Br”变成“-OH”,则在“-CHO”氧化为“-COOH”的过程中,“ ”可能也被氧化,所以必须先使“-CHO”氧化为“-COOH”,再把“-Br”取代为“-OH”,酸化只是把“-COONa”变为“-COOH”。
答案:1)
(2)B
体 验 高 考
1.有4种有机物:①CH3 ② ③ ④CH3-CH=CH-CN,其中可用于合成结构简式为 的高分子材料的正确组合为:( )
A.①③④ B.①②③ C.①②④ D.②③④
解析:根据烯烃加聚反应的原理逆推该高聚物的单体应为:CH3-CH=CH-CN, , 。
答案:D
2.化合物A(C4H10O)是一种有机溶剂,A可以发生以下变化:
(1)A分子中的官能团名称是____________________。A只有一种一氯取代物B,写出由A转化为B的化学方程式:____________________。A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种,则F的结构简式是____________________。
(2)化合物“HQ”(C6H6O2)可用做显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”还能发生的反应是(选填序号)____________________。
①加成反应 ②氧化反应 ③加聚反应 ④水解反应
“HQ”的一硝基取代物只有一种,“HQ”的结构简式是____________________。
(3)A与“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂。“TBHQ”,“TBHQ”与氢氧化钠溶液作用得到化学式为ClOH12O2Na的化合物,“TBHQ”的结构筒式是____________________。
解析:A可与Na反应,A的化学式为C4H10O,说明A中一定有-OH;由A只有一种一氯化物B,可推出A为(CH3)3C-OH,A与Cl2先光照反应只能发生在烃基上,由此可推出反应的化学方程式,F是A的同分异构体,也可发生图示变化,说明F也是醇类结合F的一氯化物有三种,可推出F的结构简式。
由化合物“HQ”的化学式,可做显影剂,可以与FeCl3溶液发生显色反应,可知“HQ”属于酚类,酚类可发生加成(有苯环),可发生氧化反应(醇羟基)。由“HQ”的一硝基取代物只有一种,可推知“HQ”为 。由A与“HQ”反应生成水和“TBHQ”,“TBHQ”与NaOH反应得到C10H12O2Na2的化合物,可推知,酚羟基没有与A结合,与A中羟基结合的应是酚羟基邻位上的氢,由此可推出“TBHQ”的结构简式。
答案: (2)①、②; (3) C(CH3)3
3.苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。已知:
(1)写出C的结构简式:____________________。
(2)写出反应②的化学方程式:____________________。(3)写出反应⑧的化学方程式:___________________。
(4)写出反应类型:④____________________,⑦____________________。
(5)下列可检验阿司匹林样品中混有水杨酸的试剂是____________________。
a.三氯化铁溶液 b.碳酸氢钠溶液 c.石蕊试液
解析: 从④的反应对象推知D为 ;从反应特征(D→E)知E为 ;从反应对象(E )知C6H10Br2为 ;从⑧的反应产物特征逆推结合⑦的反应对象特征知F为 ,①、②、③的反应可从反应对象和水杨酸的结构推知,阿司匹林结构中无酚羟基,而水杨酸( )结构中有酚羟无酚羟基,酚羟基能与Fe3+生成紫色络合物,所以选(a)三氯化铁溶液。
答案:
(1)
(2) +(CH3CO)2O +CH3COOH
(3)n
(4)加成反应;消去反应 (5)a
4.聚甲基丙烯酸羟乙酯结构简式为 ,它是制作软质隐形眼镜的材料。
请写出下列反应的化学方程式:
(1)由甲基丙烯酸羟乙酯制备聚甲基丙烯酸乙酯。
(2)由甲基丙烯酸制备甲基丙烯酸羟乙酯。
(3)由乙烯制备乙二醇。
解析:本题考查对加聚反应、酯化反应、烯烃的加成反应、卤代烃的水解反应的理解。用逆推法解题由题给高聚物的结构简式可知甲基丙烯酸羟乙酯的结构简式为CH2= COOCH2CH2OH,根据甲基丙烯酸为CH2= COOH可推知(2)的另一种反应物为HO-CH2CH2-OH。根据提示信息,制备 - 应先制 ,所以由乙烯制乙二醇首先要乙烯和卤素单质发生加成反应。
答案:
2023广东高考化学难度
2021河北新高考化学难,不少考完的学生反馈,考完化学后心态已经崩溃。
今年由于新高考政策,让一些学生原本就比较紧张,而当化学考完之后一个参加过化学竞赛的同学表示,最后三道大题几乎空白只能随便写几句,甚至有的学生直接表示要再来一年。
并不只有几名学生这样说,在社交平台上众多考完化学的学生都表示,本次化学考试难出了天际,甚至表示从来没有做过这么难的化学题。
选择题答案为:A;B;A;D;A;D;C;B;D;B;CD;A。
2021河北新高考化学难后续网友评论:
其实出现这种情况,许多网友表示早就在意料之中,去年山东新高考的第一年自主命题的科目,考完一场学生崩溃一次,因此,许多学生受到了心态的打击,导致越往后的科目发挥越失常,但身处在高考之中的学生可能没有想过,既然题目这么难,自己不会大家都不会,这样总体来说并没有拉开差距。
而且越难的题,其实对普通学生越有利,大家的差距基本上都是在基础题,如果基础题也变难的话,那最后的成绩可能分值会被拉得很小,这样考生更容易冲击本科,甚至可以捡漏最后冲击重点高校。
所以无论大家是处于哪一个年级,平时一定要多去练习,尽量将心态放平,这样才能在最后一场大型考试中发挥不会失常。
以上内容参考:高考直通车—2021河北高考化学真题
高考化学压轴题有多难
2023广东高考化学难度如下:
2023年广东高考化学有一定难度,题目创新性非常高,详细介绍如下:
一、化学难度:
1、2023广东高考化学试题难度相对较高,广东的考生结束化学考试后表示,今年的广东高考化学试题难度还可以,难度在接受的范围内。广东高考化学试题主要考查学生的化学知识和解决实际问题的能力,广东高考化学试卷总体来说有点难。
2、2023年广东高考化学试卷总体来说有点难,广东高考化学试题的选材上看,试题精选情境素材,多以专业资料文献为背景,开拓了学生的科学视野,让学生通过试题情境认识化学学科价值,从而增长知识见识。
3、2023年的广东高考化学试题难度会继续延续以往的趋势,主要考查学生的化学知识和解决实际问题的能力。从广东高考化学试题的题型上来看包括选择题、填空题、计算题、分析判断题、应用题等类型,其中选择题和填空题主要考察学生对概念和知识点的理解和记忆。
二、化学学习方法:
1、培养化学思维方式:化学学科特别注重概念的理解和实际应用。学生应该努力理解化学概念和原理,而不是仅仅记住公式和定义。培养化学思维模式的关键在于试图去理解各种过程中背后隐藏的信息,并尝试将它们联系起来。
2、注重实验操作:化学实验操作可以帮助学生更好地理解理论知识。学生应该多做实验,同时将实验操作与实验结果联系起来,从而加深对化学概念的理解。此外学生应该重视实验报告的撰写,清楚地表达实验原理实验流程和实验现象。
3、切实掌握题目类型:了解化学题目类型可以帮助学生预测题目难度和解决方法。学生应该熟悉基本的题型,如计算题、选择题和简答题,掌握解题技巧和方法。在解决问题时,学生应该注重思路策略和逻辑,尽可能减少无效时间和错误。
4、勤于反思和总结:学习化学是一个层层推进的过程。在学生学习化学的过程中,需要不断反思并总结所学知识。通过自我检查和错误分析,学生可以发现并纠正学习中的问题,从而更好地掌握化学知识。
高考化学压轴题不是很难,只要你平时认真学习,至少还是能拿八成的分数。
高考化学的难度因地区和年份而异。
1、高考化学的构成。
一般来说,高考化学的难度可以分为基础知识的理解和应用、解析和推理题目的能力以及实验技能的要求三个方面。
2、考查内容。
在基础知识的理解和应用方面,高考化学通常考察学生对化学概念、原理和公式的掌握程度,以及其在化学实际问题中的应用能力。这部分题目的难度一般不会过高,主要考查学生对基本概念的掌握和简单计算能力。
3、考察学生的能力。
在解析和推理题目的能力方面,高考化学可能考察学生对实验数据的分析与推断能力,以及对化学理论的深入理解和应用能力。
总体而言,高考化学的难度还是相对较高的,需要学生在平时的学习中建立扎实的基础,理解化学原理和概念,并能够熟练运用所学知识解决问题。同时,在考前复习中,要注重对解析和推理题目的训练,提高分析问题和解决问题的能力。
学好化学的建议:
1、建立扎实的基础。
化学是一个建立在基础概念和原理之上的学科,所以要先掌握好基本的化学知识,包括元素周期表、化学键、化学方程式等。可以通过阅读教科书、参加课堂讲解和做习题等方式来巩固基础知识。
2、多做实验。
化学实验是理论的实践,通过亲自参与实验可以更好地理解化学概念和原理。完成实验时要仔细观察、记录实验现象和数据,并学会分析实验结果。此外,要注意实验安全,遵守实验室规定和操作规程。
3、理解化学概念。
化学是一个抽象的学科,掌握好其中的概念非常重要。在学习过程中,要注重理解化学概念的内涵和逻辑关系,不仅仅是记住定义和公式。可以通过与同学或老师的讨论、查阅参考书和研究资料等方式加深对概念的理解。